Xenopus laevis (female) Unser bester Mitarbeiter |
Die Entstehung eines Organismus – ob Wurm, Fliege, Maus, Frosch oder Mensch – beginnt mit einer einzigen Zelle, der befruchteten Eizelle. Ein ausgewachsener Mensch besteht aus Milliarden von Zellen, die wiederum mehrere Hundert verschiedene Aufgaben ausüben. Um die Abläufe der frühen Entwicklung eines Organismus genau zu beobachten, bietet sich der Frosch besonders gut an, da sich seine Embryonalentwicklung außerhalb des mütterlichen Organismus abspielt. Der Froschlaich ist darüber hinaus relativ groß und somit ideal zur frühen Beobachtung und Manipulation. |
Für die Wissenschaftler ist es interessant zu erkunden, wie die Zellen geordnete Verbände für die Linse oder die Retina des Auges bilden und sich nach Organen sortieren. Die Grundzüge der Embryogenese, also Zellteilung, Zellwanderung und noch nicht erfolgte Differenzierung der Zellen werden von denselben Prinzipien geleitet, die einen Tumor ausmachen. Ihn kennzeichnet sein unkontrolliertes Wachstum, das heißt die ungebremste Zellteilung. Seine Zellen kommen ihrer ursprünglichen Aufgabe nicht mehr nach und verändern ihre Form. Sie nehmen alte Eigenschaften wieder an, wie beispielsweise die Neigung zur Wanderung, und dringen in fremde Umgebung ein. Im Fachjargon wird dies als invasives Verhalten und Neigung zur Metastasierung bezeichnet.
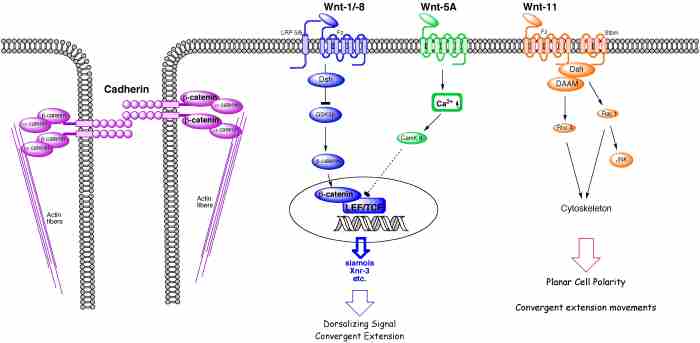
Zwischenzeitlich wurde ein neuer Signalweg entdeckt, der die Orientierung der Zellen während ihrer Wanderung steuert (Wnt-5a/Ror2-Signalweg). Fehlt eine Komponente, das Signal (Wnt-5a) oder der Signalempfänger (der Ror2-Rezeptor) finden die Zellen nicht zum Zielort; sie treten auf der Stelle oder wandern im Kreis. Noch ist unklar, ob dieser Mechanismus auch von Tumorzellen, die in gesundes Gewebe einwandern, genutzt wird. Hinweise auf eine Beteiligung von Cadherin-11 an der Metastasenbildung und der Auslösung von Arthritis gab es bereits, aber der Mechanismus war bislang nicht verstanden. Wiederum war es der Froschembryo, der half, die Besonderheiten dieses Moleküls aufzuspüren.
Normalerweise verhindern Cadherine, die wie Zellkleber wirken, dass Zellen sich aus dem Zellverband lösen und auswandern. Cadherin-11 hingegen verhält sich völlig anders. Seine Gegenwart sorgt für die Bildung von Zellausläufern, die den geeigneten Wanderungsweg 'ertasten'.
Die Aufklärung des Wnt-5a/Ror2-Signalweges und neue(n) Funktion und Eigenschaften des Cadherin-11 Proteins bilden die Grundlage unserer Forschung.
Wir lehren Tierphysiologie, Entwicklungsbiologie, Zellbiologie und Molekularbiologie.